Oligodendrogliooman hoidon tavoitteena on pienentää tai poistaa kasvainta samalla lieventäen oireita, pysäyttää kasvaimen eteneminen ja pidentää potilaan elinaikaa. Seuraavassa käsitellään eri hoitovaihtoehtoja ja niiden yhdistelmiä. Selitämme , mihin hoidot perustuvat, mitä niillä voidaan saada aikaiseksi ja miten ne toteutetaan. Kerromme myös hoitojen sivuvaikutuksista.
Leikkaus
Aivokasvainleikkauksen tekee neurokirurgi, joka on erikoistunut aivojen ja selkäytimen leikkauksiin. Aina kun mahdollista, neurokirurgi yrittää poistaa kasvaimen kokonaan. Glioomat kasvavat kuitenkin hajanaisesti, niiden rajat eivät ole tarkat. Kasvaimen sisällä on normaaleja, toimivia hermosoluja ja kasvainta ympäröivässä normaaliaivossa on yksittäisiä kasvainsoluja. Yleensä poistetaan niin paljon kuin arvioidaan turvalliseksi. Tämä on hyvin haasteellista, koska esim. toiminnan ohjauksen rataverkot sijaitsevat miltei kaikkialla aivoissa. Yleensä pyritään välttämään ennen kaikkea halvausoireiden, näköhäiriöiden tai puhehäiriöiden aiheuttamista. Joskus kasvain on niin laajalla alueella, että päädytään ottamaan koepala, koska isomman palan ottaminen ei hyödyttäisi ja voisi aiheuttaa merkittävää haittaa. On alueita, joiden leikkaaminen aiheuttaisi välittömän hengenvaaran, kuten aivorungon alue, jolloin neulanäytteen ottokin voi olla haasteellista.
Mitä leikkauksessa tapahtuu?
Kasvaimesi poistamiseksi neurokirurgi tekee suurehkon reiän kalloon. Tätä toimintoa kutsutaan kraniotomiaksi eli kallon (cranium=kallo) avaukseksi (tome=leikata). Se on yleisin aivokasvainten leikkaustapa.
Kraniotomia tehdään yleensä siten, että potilas on nukutettuna. Valvekraniotomioissa potilas herätetään kesken leikkauksen, kun halutaan tutkia joidenkin aivojen osien toimintaa ja välttää vaurioita. Näitä tehdään hyvin harvoin,
Jos kaikki magneettikuvissa näkyvä kasvain pystytään poistamaan, tätä kutsutaan kasvaimen resektioksi. Kasvaimesta voidaan pystyä poistamaan myös vain osa,nk. osaresektio tai sitten ottaa vain koepala. Usein kasvaimesta otetaan pieni näyte heti leikkauksen alussa ja se lähetetään jäädytettynä patologille, joka antaa pikavastauksen. Tämän vastauksen perusteella leikkausta sitten jatketaan joko pyrkien täydelliseen poistoon tai osapoistoon.
Kraniotomian kesto vaihtelee sen mukaan, mitä aivojen osaa leikataan. Yleensä se kestää noin 4-6 tuntia, mutta voi olla pidempikin, jopa yli 10 tuntia. Pitkät leikkaukset liittyvät yleensä kallonpohjan ja silmän takaisten kasvainten leikkaukseen, jossa joudutaan varomaan monia hermoja ja verisuonia ja eteneminen on hyvin hidasta. Oligodendroglioomat sijaitsevat hyvin harvoin kallonpohjassa.
Miten leikkaukseen menoon voi valmistautua?
Ennen leikkausta neurokirurgi keskustelee kanssasi, mitä on odotettavissa. Kysy kaikki mieltäsi askarruttavat kysymykset, ei ole tyhmiä kysymyksiä. Jos mahdollista, ota joku läheinen mukaasi tähän tapaamiseen. Kannattaa myös kirjoittaa lista asioista, jotka sinua askarruttavat, jotta mikään sinulle tärkeä asia ei unohdu kysyä.
Yleisesti voidaan todeta, että kannattaa pyrkiä liikkumaan kohtuullisesti ennen leikkausta, jotta hengitys ja verenkierto ovat mahdollisimman hyvässä kunnossa. Tässä ei pidä liioitella, maratonit ja muut kovat ponnistukset eivät ole suositeltavia. Sen sijaan rauhallista kävelyä voi tehdä pitempäänkin päivässä. Kannattaa kysyä leikkaavalta lääkäriltä, onko hänellä suosituksia liikunnasta, ruokavaliosta tms. Jos ennen leikkausta joutuu syömään kortisonia esim. deksametasonia, tämä voi luonnollisesti häiritä unta ja vaikuttaa lihaskuntoon. Jos tähän liittyy mieltä askarruttavia kysymyksiä, ne kannattaa myös esittää leikkaavalle lääkärille.
Sädehoito
Tämä tietopaketti auttaa sinua valmistautumaan sädehoitoon. Kerromme mitä tapahtuu ennen hoitoa, sen aikana ja jälkeen. Saat tietoa siitä, mihin sädehoito perustuu. Myös sivuvaikutuksista löydät tietoa.
Aivokasvaimiin annetaan yleisimmin ulkoista sädehoitoa sädehoitolaitteella. Tämä korkeaenerginen rtg-säteily (=ionisoiva säteily) eli fotonisäteily vaurioittaa solujen perimää eli DNAta niin, että solut lopulta kuolevat. Sädehoito annetaan päivittäin pieninä annoksina aivojen sietämään tasoon asti. Terveet solut kykenevät korjaamaan säteilyn aiheuttamat vauriot, mutta näillä annoksilla syöpäsolut kuolevat.
Miten sädehoito annetaan?
Ulkoista sädehoitoa annetaan kehon ulkopuolelta sädehoitolaitteella. Myös aivokasvainten, kuten oligodendrogliooman sädehoito annetaan yleisimmin tällä tavalla. Sädehoitolaite näyttää suurelta röntgenlaitteelta tai tietokonetomografilta. Potilas on makuulla hoitopöydällä. Sädehoitolaite ei kosketa häntä, vaan yleensä pyörii potilaan ympärillä kenttien suuntaamiseksi. Laite pitää jonkin verran ääntä. Hoito kestää vain muutaman minuutin kerrallaan eikä ole kivuliasta eikä tunnu miltään. Tällainen tavanomainen sädehoito ei myöskään tee hoitokohteita radioaktiiviseksi. Mitään säteilyä ei siis lähde sädehoidetusta potilaasta.
Konetta käytetään sädehoitohuoneen ulkopuolelta, mutta hoitaja seuraa sinua kameran kautta ja on sinuun tarvittaessa puheyhteydessä. Hoito annetaan tavallisesti kerran päivässä lyhyenä jaksona. Näitä hoitokertoja kutsutaan hoitojaksoiksi eli fraktioiksi.
Yleensä sädehoitoa annetaan useasta suunnasta. Käyttämällä useaa suuntaa, saadaan tehokkain mahdollinen annos aivokasvaimen alueelle ja säästetään normaaliaivoja säteilyltä kts. Kuva H2.
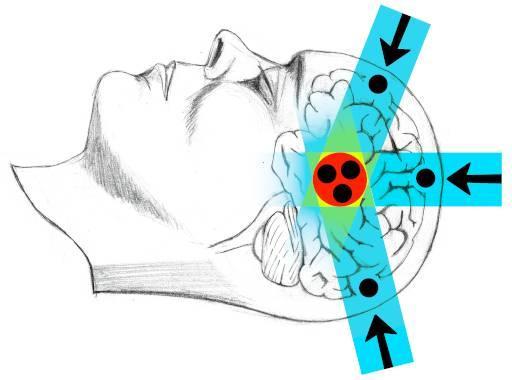
tavanomaisesta sädehoidosta.
Sädehoito annetaan tavallisesti siten, että hoidoissa käydään kotoa käsin; sairaalassa ei hoitojen vuoksi tarvitse olla. Luonnollisesti, mikäli potilas on huonokuntoinen tai matka sädehoitoon on kovin pitkä, voi joutua olemaan sairaalassa sisällä. Tämä on useimmiten poikkeus. Hoitojaksojen määrä riippuu kasvaimen tyypistä ja hoidon tavoitteesta. Lääkäri, sairaanhoitaja tai röntgenhoitaja selittää hoitosuunnitelman sinulle.
Aivokasvaimen hoidon alussa potilaalle tehdään naamari eli maski muovailtavasta aineesta. Lämmitettynä muoviverkon tapainen aine on pehmeää. Verkko tuntuu vain lämpimältä, se ei ole kuuma. Se kovettuu, kun se jäähtyy huoneenlämpöiseksi. Suun ja silmien kohdalle tehdään aukot. Maskin avulla potilaan pää voidaan kiinnittää hoitolaitteeseen niin, että hän on aina täsmälleen samassa kohdassa ja sädehoito voidaan kohdistaa juuri sinne, minne pitääkin. Tarkkuus kohdennuksessa on muutaman millimetrin luokkaa. Miltä maski näyttää voit katsoa tästä Kuva H3. Maskia käytetään vain itse sädehoidon aikana.

Hoitosuunnitelma
Hoitosuunnitelma tehdään magneetti- ja tietokonekuvien perusteella. Säteily piirretään kuviin ja koneellisesti sitten lasketaan kullekin alueelle tuleva sädehoitoannos ja hoitokertojen lukumäärä. Nykyisillä uusilla sädehoitolaitteilla voidaan antaa eri osiin kasvainaluetta eri annoksia. Joskus tässä käytetään hyväksi isotooppitutkimusta, jotta tiedetään, missä kohtaa kasvainta solut jakaantuvat.
Sädeannos
Sädehoidon annosyksikkö on Gray, lyhennetään Gy. Gy mittaa kudokseen imeytyneen energian määrää. Yleensä aivokasvaimen hoidoksi annetaan 45-60 Gy kokonaisannos ja yhden hoitokerran eli fraktion annossuuruus on 1,8-2 Gy:tä. Matala-asteisiin glioomiin, kuten oligodendroglioomaan, riittää uusimman tutkimuksen mukaan 45-55Gy kokonaisannos. Se on yhtä tehokas kuin korkeampi, 56-60 Gy ja alemmasta annoksesta tulee vähemmän sivuvaikutuksia.
Hoitoa annetaan useimmiten 5nä päivänä viikossa, joten helposti kuluu 4-6 viikkoa, koska yksi päivittäinen annos on vain tuon 1,8-2 Gy:tä. Yksittäinen hoitokerta voi kestää vain muutaman minuutin. Varsinkin hoidon loppupuolella hoitokerta on lyhyt, kun kaikki on jo hiottua, tuttua ja menee sujuvasti.
Sädehoidon jälkeen
Sädehoidon jälkeen aloitetaan usein solunsalpaajahoito, ei kuitenkaan aina. Yleensä pidetään noin kuukauden tauko sädehoidon jälkeen, ennen kuin solunsalpaajahoito aloitetaan.
Mikäli sädehoidon aikana on annettu kortisonihoitoa, useimmiten deksametasonia, annosta ruvetaan vähitellen purkamaan sädehoidon päätyttyä. Aivojen alueen turvotus, jota sädehoito aiheuttaa, on suurimmillaan sädehoidon loppupuolella ja hoidon loputtua.
Mikäli kortisonin purku lisää oireita, kuten väsymystä tai päänsärkyä, voidaan kortisonin purkuaikataulua venyttää. On suositeltavaa olla yhteydessä hoitohenkilökuntaan, mikäli kortisonin lopettamisen kanssa tulee ongelmia.
MRI (magneettikuvaus) kontrollia ei yleensä kannata ottaa ennen kuin noin 3 kuukautta vähintään on kulunut sädehoidon päättymisestä. Syy tähän on se, että sädehoito aiheuttaa monia, MRI-kuvissa näkyviä muutoksia, jotka sitten vähitellen katoavat kuvista.
Mitään oireita näistä muutoksista ei välttämättä tule, mutta kuvissa ne näkyvät. Jos kuva otetaan pian sädehoidon jälkeen, joudutaan useimmiten ottamaan uusi kuva jonkun ajan päästä eikä näiden kuvien perusteella pystytä ottamaan kantaa sen paremmin kasvaimen tilanteeseen kuin potilaan hoitoihinkaan. Siksi kuvan oton kanssa pidetään taukoa.
Sytostaatit eli solunsalpaajat
Keskeinen hoitomuoto oligodendroglioomissa ovat solunsalpaajat eli sytostaatit. Ne estävät solujen kasvua, jakautumista ja uusien solujen kehittymistä. Solunsalpaajia voidaan antaa yksinään tai sitten yhdessä sädehoidon kanssa. Jos oligodendroglioomaa luokkaa (gradusta) II hoidetaan ensimmäistä kertaa, solunsalpaaja annetaan vasta sädehoidon jälkeen.
Mitä solunsalpaajat ovat?
Solunsalpaajat ovat kemiallisia aineita, jotka joko tappavat soluja tai estävät niitä jakautumasta. Ne ovat siis pohjimmiltaan myrkkyjä. Ne vaikuttavat myös terveisiin jakaantuviin soluihin, mutta terveet solut pystyvät korjaamaan vaurioitaan paremmin kuin syöpäsolut.
Miten solunsalpaajat vaikuttavat?
Solunsalpaajat ryhmitellään ensisijaisen vaikutustavan perusteella. Vaikutukset kohdistuvat solujen perimään, joko suoraan DNA:n rakenteeseen tai välillisesti DNA:n kahdentumiseen tai muodostumiseen. Jotkut solunsalpaajat vaikuttavat solunjakaantumiseen muuta kautta esim. estämällä nk. mirotubulusten (pikkupikkuputkiloiden) muodostumista, jotka ovat solun jakaantumiselle välttämättömiä. Monilla solunsalpaajilla on useita vaikutusmekanismeja.
Aivokasvainten solunsalpaajahoitoon liittyy erityinen haaste. Lääke ei voi vaikuttaa ellei se mene kasvaimeen. Kaikissa glioomissa on soluja, jotka ovat veri-aivo-esteen (engl. blood-brain barrier= BBB), takana. Veri-aivo-esteessä aivojen verisuonien seinät yhdessä joidenkin tukisolujen kanssa ovat erikoisen tiiviitä ja estävät näin myrkyllisten aineiden pääsemisen aivoihin vaurioittamaan aivoja. Kasvaimen ollessa kyseessä veri-aivoeste voi estää tai hidastaa solusalpaajien pääsyä aivokasvaimiin.
Miksi solunsalpaajia annetaan?
Solunsalpaajien on osoitettu olevan tehokkaita hoitamaan joitakin aivokasvaimia. Erityisesti oligodendrogliooma on osoittautunut herkäksi solusalpaajille. Solunsalpaajien määräämisessä otetaan huomioon kasvaimen tyyppi, laajuus, vaihe, potilaan kunto ja ikä.
Koska solunsalpaajat leviävät kaikkialle elimistöön, niillä päästään hoitamaan myös sellaisia yksittäisiä kasvainsoluja, jotka sijaitsevat varsinaisen kasvaimen ulkopuolella. Niillä voidaan myös estää sädehoidon saaneita kasvainsoluja korjaamasta itseään. Joskus niitä käytetään pienentämään kasvainta tai hillitsemään sen kasvua.
Miten solunsalpaajia annetaan?
Solunsalpaajia voidaan antaa suun kautta tabletteina tai sitten ruiskeena tai tiputuksina suoraan suoneen. Joissakin tapauksissa solunsalpaajia on annettu suoraan leikkausonteloon ikään kuin jäännöskasvaimen keskelle joko leikkauksen yhteydessä tai sen jälkeen. Tällöin leikkaus onteloon laitetaan letku, jonka päässä oleva litteä kapseli jätetään ihon alle. Ruiskeita annetaan sitten ihon läpi kapseliin, josta se menee letku a pitkin leikkausonteloon. Tämä voi kuullostaa monimutkaiselta, mutta itse asiassa on melko yksinkertaista ja hyvin siedettyä. Valitettavasti tällä menetelmällä ei kuitenkaan ole saatu sen parempia tuloksia kuin muilla hoidoilla. Hyvin harvoin solunsalpaaja ruiskutetaan selkäydinnesteeseen lannepistoneulan kautta.
Useimmiten solunsalpaajia annetaan jaksoina eli kuureina. Kuuri koostuu hoitopäivistä ja taukopäivistä.
Hyvin yleisesti aivokasvainpotilaille annettu solunsalpaaja temotsolomidi otetaan suun akutta kapseleina. Kuuri on useimmiten 28pv eli 4 viikon kestoinen. Ensin lääkettä otetaan suun kautta kerran päivässä 5 päivän ajan tyhjään vatsaan ja sitten pidetään 23 päivää taukoa.
Toinen yleinen suun kautta tyhjään vatsaan otettava lääke lomustiini (CCNU) otetaan kerta-annoksena 6 viikon välein. Annos on kerralla usein 50-80mg kehon pinta-alaa (=neliömetriä) kohti. Kehon pinta-ala lasketaan pituudesta ja painosta laskukaavoilla. Suurusluokaltaan se vaihtelee pinene, kevyn naisen n. 1,5m2sta isokokoisen miehen n- 2,5 m2.
Aiemmin oligodendroglioomaa hoidettiin usein PCV-solunsalpaajayhdistelmällä. Yhdistelmää on viime aikoina tutkittu uudestaan. On haluttu selvittää, onko se kuitenkin tehokkaampi hoitamaan oligodendroglioomia kuin temostsolomidi yksinään.
PCV on lyhenne nimistä Prokarbatsiini (Natulan®), CCNU (Lomustiini) ja Vinkristiini (Oncovin®). Prokarbatsiinia annetaan suun kautta 1-3 kertaa päivässä usein 2 viikon jaksoina, lomustiinia kerran 6ssa viikossa suun kautta ja vinkristiiniä muutaman minuutin tiputuksena kerran viikossa. Kun solunsalpaajaa, kuten vinkristiiniä annetaan tiputuksena, joutuu olemaan sairaalassa tai poliklinikalla sisällä tiputuksen ajan. Yleensä sitten pääsee kotiin.
Minkälaisia sivuvaikutuksia solunsalpaajilla voi olla?
Koska solunsalpaajat ovat myrkyllisiä, niillä on monia sivuvaikutuksia. Sivuvaikutukset ovat kuitenkin yleensä hallittavissa joko lääkityksellä tai annostelua muuttamalla. Sivuvaikutukset vaihtelevat suuresti potilaan ja lääkkeen mukaan. Erityisesti aiemmin pahoinvointi oli erittäin hankala sivuvaikutus. Nyt siihen on useita eri lailla vaikuttavia lääkkeitä, joilla pahoinvointi yleensä saadaan hyvin hallintaan. Seuraavassa käydään läpi yleisimpiä sivuvaikutuksia, luettelo ei luonnollisestikaan sisällä kaikkia sivuvaikutuksia. Osa on hyvin harvinaisia. Sivuvaikutuksista pitää aina keskustella hoitavan tahon kanssa. Osa sivuvaikutukissta johtaa lääkeen annoksen muutoksiin välittömästi ja joskus lääkkeen lopetukseen. Siksi hoitavan tahon tulee tietää, mikäli sinulle tulee sivuvaikutuksia.
Kokeellisia hoitoja
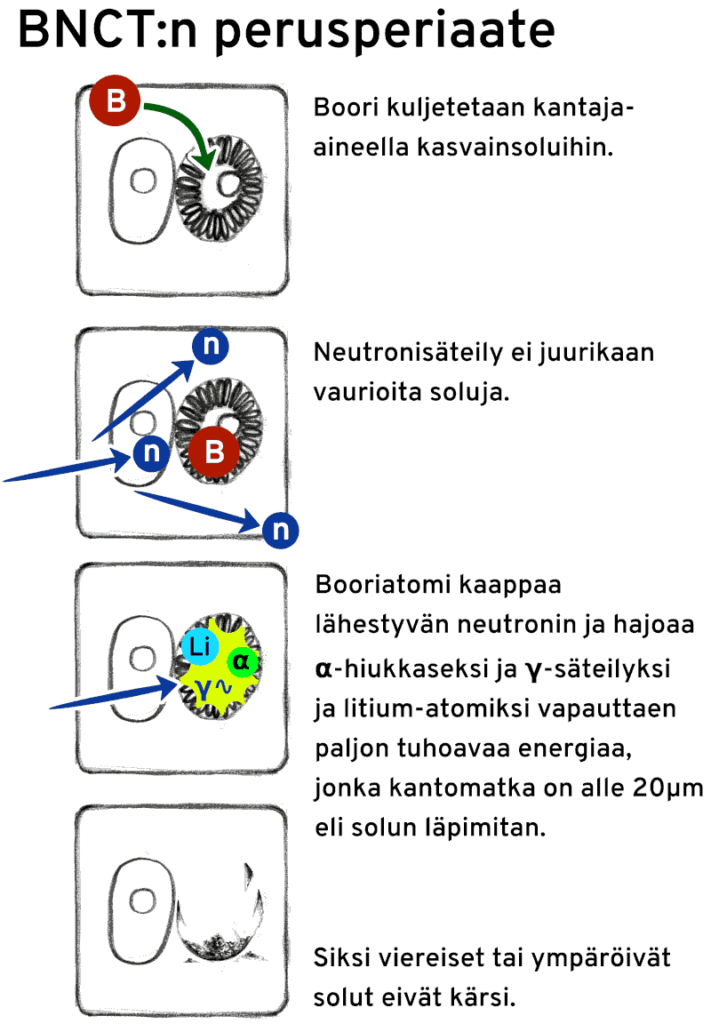
Boori-neutronikaappaushoito (BNCT)
Boori-neutroni kaappauksesta eli BNCT:stä kirjoitetaan satunnaisesti mediassa. Tällöin monet kiinnostuvat siitä ja olen ajoittain saanut vastatakseni kysymykset:
Mitä on boori-neutroni kaappaushoito? Voisiko kasvaintani hoitaa sillä?
BNCT eli boorineutronikaappaushoito on kokeellinen sädehoito. Se kohdennetaan aineenvaihdunnan avulla ja säteilynä on neutroneja. Aivokasvainten hoitotulokset eivät ole olleet kovin hyviä. Tällä hetkellä BNCT-hoitoa ei anneta Suomessa eikä Pohjoismaissa millekään potilasryhmälle. Kun säteilylähde on valmis, on Helsingissä tarkoitus aloittaa pään ja kaulan alueen syöpäpotilaiden hoidolla. Aivokasvaimia EI lueta pään ja kaulan alueen syöpiin.
Protonihoito
Protonihoitoa voidaan ohjata tarkemmin kuin perinteistä sädehoitoa ja vähentää ympäröivän, terveen kudoksen sädeannosta. Erot eivät kuitenkaan ole kovin suuret nykyiseen, kehittyneeseen tavanomaiseen sädehoitoon verrattuna. Mikään ihmehoito se ei ole eikä esim. glioomissa siitä ole juuri osoitettua hyötyä.
Seuraavassa selitetään, miten protonihoito toimii ja minkälaisissa kasvaimissa siitä voi olla hyötyä.